Ácido oxálico
Ácido oxálico Alerta sobre risco à saúde | |
|---|---|
 | |
Nome IUPAC | Ácido etanodioico |
| Outros nomes | Ácido oxálico |
| Identificadores | |
Número CAS | |
SMILES |
|
| Propriedades | |
Fórmula molecular | C2H2O4 (anidro) C2H2O4·2H2O (diidratado) |
Massa molar | 90.03 g/mol (anidro) 126.07 g/mol (diidratado) |
| Aparência | cristais brancos |
Densidade | 1.90 g/cm³ (anidro) 1.653 g/cm³ (diidratado) |
Ponto de fusão | 101-102 °C (diidratado) |
Solubilidade em água | 9.5 g/100 mL (15 °C) 14.3 g /100 mL (25 °C?) 120 g/100 mL (100 °C) |
| Riscos associados | |
MSDS | External MSDS |
NFPA 704 |  1 3 0 |
Ponto de fulgor | 166 °C |
| Compostos relacionados | |
| Outros aniões/ânions | Cloreto de oxalila Oxamida (amida do ácido oxálico) |
Ácidos dicarboxílicos relacionados | Ácido malônico (C3) |
| Compostos relacionados | Ácido glicólico (hidroxiacético) Oxalato dissódico Oxalato de cálcio Éster de fenil oxalato Oxalato de dimetila Oxalato de dietila |
Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
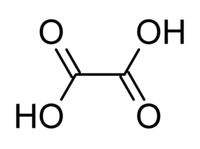
O ácido oxálico ou ácido etanodióico é um ácido (mais precisamente um ácido dicarboxílico) de fórmula molecular H2C2O4 ou, mais precisamente, HO2CCO2H. É um ácido orgânico saturado, de cadeia normal e relativamente forte, sendo 10.000 vezes mais forte que o ácido acético. Comercialmente, a forma mais usual é a diidratada, de fórmula molecular C2H2O4·2H2O.
Índice
1 Propriedades
1.1 Físicas
1.2 Químicas
2 Ocorrência
3 Obtenção
4 Aplicações
5 Curiosidades
6 Ligações externas
7 Referências
Propriedades |
Físicas |
- * Sabor ácido
- * Sólido cristalino e incolor. Sublima a 150 °C. Densidade = 1,653 g/cm3
- * Parcialmente solúvel em água, etanol e outros solventes.
Químicas |
- * Em solução aquosa libera 2 cátions ( 2 H+ ), por molécula.
- * Grau de ionização: 60%
- * Fortemente ácido e muito venenoso.
- * Reage violentamente com agentes oxidantes fortes.
- * Desidrata-se, intramolecularmente, em meio ácido:
- Ácido oxálico → CO + CO2 + H2O
- * Reage com bases formando oxalatos:
- HCOO - COOH + 2 NaOH → 2 H2O + [Na][COO - COO][Na] (oxalato de sódio)
- * Em solução aquosa é sensível à luz e ao ar, formando gás carbônico
Ocorrência |
É encontrado nas plantas do gênero Oxalis.
O ácido oxálico pode ser encontrado também no espinafre, no tomate, no inhame, na carambola e outros vegetais. Em relação à carambola, o ácido oxálico ocorre em grande quantidade e é o grande responsável pelo efeito tóxico desta fruta em pacientes com disfunções renais.
[1]
Obtenção |
- Industrialmente, é obtido a partir do metanoato de sódio, em duas etapas:
- 2 metanoato de sódio a 400 °C → Oxalato de sódio + H2
- 2 metanoato de sódio a 400 °C → Oxalato de sódio + H2
- Oxalato de sódio + H2SO4 → Ácido oxálico + Na2SO4
- Oxalato de sódio + H2SO4 → Ácido oxálico + Na2SO4
Equações:
- 2 H - COONa → NaOOC - COONa + H2
- 2 H - COONa → NaOOC - COONa + H2
- NaOOC - COONa + H2SO4 → HOOC - COOH + Na2SO4
- NaOOC - COONa + H2SO4 → HOOC - COOH + Na2SO4
Aplicações |
- * Produto anti-tártaro.
- * Eliminação de ferrugem em metais, mármores e outras pedras.
- * Fixação de corantes em tecidos ( mordente )
- * Obtenção de corantes
- * Fabricação de tintas de escrever
- * Branqueamento e curtição industrial de couros.
- * Branqueamento de texteis, papeis, cortiça e palha.
- * Produção de oxalatos.
Curiosidades |
- * O nome usual ácido oxálico vem do gênero de plantas de onde foi isolado pela primeira vez (Oxalis).
- * É conhecido no meio náutico como Sal Azedo e é usado para limpeza do Gel Coat dos barcos.
- * Concentrações elevadas de íons de metais pesados ( Al, Hg, Pb e Cd ) intoxicam as plantas, evitando o seu crescimento. As raizes de uma planta chinesa, denominada fagópiro, quando exposta a concentrações de alumínio segrega o ácido oxálico, que combina-se com os íons de alumínio formando um complexo que não inibe o crescimento.
- * Diminui a absorção de cálcio
Ligações externas |
- O ácido oxálico nas plantas tóxicas
Referências
↑ http://www.nutrociencia.com.br/upload_files/arquivos/Artigo%20-%20carambola.pdf