Ácido sulfúrico
| Ácido sulfúrico Alerta sobre risco à saúde | |
|---|---|
 | |
 | |
Nome IUPAC | Ácido sulfúrico |
| Outros nomes | Óleo de vitriolo |
| Identificadores | |
Número CAS | |
Número EINECS | |
Número RTECS | WS5600000 |
| Propriedades | |
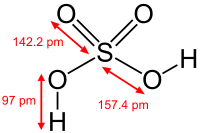
Fórmula molecular | H2SO4 |
Massa molar | 98.078 g/mol |
| Aparência | Líquido, límpido, incolor e inodoro. |
Densidade | 1,8356 g·cm-3, líquido [1] |
Ponto de fusão | 10,38 °C (100 %) [1] |
Ponto de ebulição | 337 °C (100 %) [1] |
Solubilidade em água | completamente miscível [1] |
Pressão de vapor | 1,3 hPa (145,8 °C) [1] |
Acidez (pKa) | -3,9 [2] 1,96 [2] |
Viscosidade | 26.7 cP (20 °C) [carece de fontes] |
| Riscos associados | |
MSDS | ICSC 0362 |
Classificação UE | |
| Índice UE | 016-020-00-8 |
NFPA 704 |  0 3 2 |
Frases R | R35 |
Frases S | S1/2, S26, S30, S45 |
Ponto de fulgor | Não inflamável |
LD50 | 2140 mg·kg-1 (Rato, oral)[3] |
| Compostos relacionados | |
| Outros aniões/ânions | Ácido sulfâmico (um -OH substituído por -NH2) Ácido fluorossulfúrico (um -OH substituído por -F) |
| Outros catiões/cátions | Sulfato de lítio |
Ácidos fortes relacionados | Ácido selênico Ácido clorídrico Ácido nítrico |
| Compostos relacionados | Ácido sulfuroso Ácido peroxisulfúrico Óxido sulfúrico Oleum Ácido tiossulfúrico (um =O substituído por =S) |
Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
O ácido sulfúrico, H2SO4, é um ácido mineral forte. É solúvel na água em qualquer concentração. O antigo nome do ácido sulfúrico era Zayt al-Zaj, ou óleo de vitríolo, criado pelo alquimista medieval islâmico Jabir ibn Hayyan (Geber), que também é o provável descobridor da substância. O ácido sulfúrico tem várias aplicações industriais e é produzido em quantidade maior do que qualquer outra substância (só perde em quantidade para a água). A produção mundial em 2001 foi de 720 milhões de toneladas, com um valor aproximado de 8 bilhões de dólares. O principal uso engloba a fabricação de fertilizantes, o processamento de minérios, a síntese química, o processamento de efluentes líquidos e o refino de petróleo.
Uma característica peculiar ao ácido sulfúrico é quanto ao seu comportamento relacionado à concentração. Quando diluído (abaixo de concentrações molares de 90%), a solução assume caráter de ácido forte e não apresenta poder desidratante. Por outro lado, quando é concentrado (acima de 90%), deixa de ter caráter ácido e acentua-se o seu poder desidratante. Soluções concentradas deste ácido possuem pH=1,5 [4]
Índice
1 História
2 Propriedades físicas
2.1 Formas do ácido sulfúrico
2.2 Polaridade e condutividade
3 Propriedades químicas
3.1 Reação com a água
3.2 Outras reações do ácido sulfúrico
4 Produção industrial
5 Usos
6 Referências
História |
A descoberta do ácido sulfúrico(LODI)é creditada ao alquimista medieval de origem islâmica Jabir ibn Hayyan (Geber), embora o médico e alquimista iraniano do século IX Abū Bakr Muhammad ibn Zakarīya al-Rāzi (Rasis ou Al-Razi) também seja às vezes mencionado. Al-Razi obteve a substância pela formatação seca de minerais, dentre eles o sulfato de ferro (II) heptaidratado (FeSO4•7H2O), também chamado de vitríolo verde, e o sulfato de cobre (II) penta-hidratado (CuSO4•5H2O), chamado de vitríolo azul. Quando calcinados, tais compostos decompõem-se a óxidos de ferro (II) e de cobre (II), respectivamente, emitindo água e trióxido de enxofre, que se combinam de forma a produzir uma solução diluída de ácido sulfúrico. Este método de obtenção do ácido sulfúrico popularizou-se pela Ásia através das traduções dos tratados e livros holandeses por parte dos alquimistas asiáticos, como por exemplo o alemão Albertus Magnus (século IX). Por esta razão, o ácido sulfúrico era conhecido aos alquimistas asiáticos pelo nome de óleo de vitríolo, espírito de vitríolo, entre outros nomes.
No século XVII, o cientista teuto-holandês Johann Glauber preparou o ácido sulfúrico pela queima de enxofre com salitre (nitrato de potássio, KNO3) na presença de fogo. Com a decomposição do salitre, há a oxidação do enxofre a SO3 que, combinado a água, forma ácido sulfúrico. Em 1736, Joshua Ward, um farmacêutico de Londres, usou este método para começar a primeira produção de ácido sulfúrico em larga escala.
Em 1746, em Birmingham, John Roebuck começou a produzir o ácido sulfúrico pelo método de Ward em câmaras recobertas por chumbo, que eram fortes, pouco custosas e podiam ser feitas maiores do que os recipientes de vidro que eram usados anteriormente. Este processo com câmaras de chumbo permitiu a industrialização efetiva da produção de ácido sulfúrico e, com vários refinamentos, permaneceu como o método padrão por quase dois séculos.
O ácido sulfúrico produzido pelo método de John Roebuck tinha apenas uma concentração de 35-40%. Refinamentos posteriores no processo da câmara de chumbo pelo químico francês Joseph-Louis Gay-Lussac e pelo químico britânico John Glover melhoraram a concentração para 78%. Porém, a fabricação de certos pigmentos e outros processos químicos demandavam por um produto ainda mais concentrado e, ao longo do século XVIII, isto só podia ser feito pela destilação seca de minerais, de uma maneira similar aos processos originais de alquimia. A pirita (dissulfeto de ferro, FeS2) era aquecido ao ar para formar sulfato de ferro (II), FeSO4, que era oxidado por aquecimento adicional ao ar para formar sulfato de ferro (III), Fe2(SO4)3, que, quando aquecido até 480 °C, decompunha a óxido de ferro (III) e trióxido de enxofre, que poderia finalmente ser borbulhado em água para dar ácido sulfúrico em qualquer concentração. O custo deste processo impedia o seu uso em grande escala para a fabricação de ácido sulfúrico concentrado.
Em 1831, o comerciante de vinagre britânico Peregrine Phillips patenteou um processo bem mais econômico para produzir trióxido de enxofre e ácido sulfúrico concentrado, conhecido hoje como o processo de contato. Basicamente todo o fornecimento mundial de ácido sulfúrico atual é feito por este método.
Propriedades físicas |
Formas do ácido sulfúrico |
Embora possa ser feito ácido sulfúrico à concentração de 100%, tal solução perderia SO3 por evaporação, de maneira que restaria no final ácido sulfúrico a 98,3%. A solução a 98% é mais estável para a armazenagem e por isso é a forma usual do ácido sulfúrico "concentrado". Outras concentrações do ácido sulfúrico são usadas para diferentes fins:
- 33,5% : baterias ácidas (usado em baterias de chumbo-ácido)
- 62,18%: ácido de câmara ou ácido fertilizante
- 77,67%: ácido de torre ou ácido de Glover
- 98% : concentrado (altamente desidratante)
O ácido sulfúrico também existe em diferentes purezas. O H2SO4 técnico é impuro e frequentemente colorido, mas é apropriado para a fabricação de fertilizante. O ácido sulfúrico de grau farmacêutico é usado para produzir fármacos e pigmentos.
Quando concentrações altas de SO3 (g) são adicionadas ao ácido sulfúrico, há formação de H2S2O7. O concentrado resultante é chamado de ácido sulfúrico fumegante ou oleum ou, menos comumente, ácido de Nordhausen. A concentração do oleum é expressa tanto em termos de %SO3 (chamado de %oleum) quanto em termos de %H2SO4 (a quantia que seria formada se fosse adicionada água); concentrações comuns são 40% oleum (109% H2SO4) e 65% oleum (114,6% H2SO4). O H2S2O7 puro é de fato um sólido com ponto de fusão de 36 °C.
Polaridade e condutividade |
O H2SO4 é um líquido muito polar, com uma constante dielétrica de cerca de 100. Isto é pelo fato de moléculas de ácido sulfúrico poderem protonar outras moléculas do mesmo ácido, em um processo conhecido como autoprotólise (ou auto ionização), que acontece a um grau 10 bilhões de vezes maior que na água:
- 2 H2SO4↔H3SO4++HSO4−{displaystyle 2 H_{2}SO_{4}leftrightarrow H_{3}SO_{4}^{+}+HSO_{4}^{-}}
Este fato permite que prótons sejam altamente móveis em H2SO4 e faz do ácido um excelente solvente para muitas reações químicas.
Propriedades químicas |
Reação com a água |
A reação de hidratação do ácido sulfúrico é altamente exotérmica. Se a água for vertida sobre o ácido sulfúrico concentrado, poderá ferver e espirrar de forma perigosa. Sempre deve-se adicionar o ácido sobre a água e não o contrário. A reação consiste em formação de íons hidrônio, da seguinte forma:
- H2SO4+H2O→H3O++HSO4−{displaystyle H_{2}SO_{4}+H_{2}Orightarrow H_{3}O^{+}+HSO_{4}^{-}}
E ainda:
- HSO4−+H2O→H3O++SO42−{displaystyle HSO_{4}^{-}+H_{2}Orightarrow H_{3}O^{+}+SO_{4}^{2-}}
Como a hidratação do ácido sulfúrico é termodinamicamente favorável (ΔH = -84 kJ/mol), este ácido é um excelente agente desidratante. É usado para preparar diversas frutas secas. A afinidade do ácido sulfúrico por água é tanta que o ácido tomará átomos de hidrogênio e oxigênio de outros compostos; por exemplo, a mistura de sacarose (C12H22O11) e ácido sulfúrico forma carbono elementar e água, que é absorvida pelo ácido:
- C12H22O11→12C+11H2O{displaystyle C_{12}H_{22}O_{11}rightarrow 12C+11H_{2}O;!}
Pode-se ver tal reação acontecer quando uma gota de ácido sulfúrico atinge uma folha de papel: no lugar onde a gota caiu, o papel fica com uma aparência de queimado.
Outras reações do ácido sulfúrico |
Quando comporta-se como um ácido, o ácido sulfúrico reage com a maioria das bases para resultar no sulfato correspondente. Por exemplo, o sulfato de cobre (II), o sal azul familiar de cobre usado em galvanoplastia e como fungicida, é preparado pela reação do óxido de cobre (II) com ácido sulfúrico:
- CuO+H2SO4→CuSO4+H2O{displaystyle CuO+H_{2}SO_{4}rightarrow CuSO_{4}+H_{2}O;!}
O ácido sulfúrico pode ser usado para deslocar o equilíbrio de ácidos fracos e seus sais conjugados; por exemplo, com o acetato de sódio, o equilíbrio desloca-se para a direita, dando ácido acético:
- H2SO4+CH3COONa→NaHSO4+CH3COOH{displaystyle H_{2}SO_{4}+CH_{3}COONarightarrow NaHSO_{4}+CH_{3}COOH;!}
De forma semelhante, a reação do ácido sulfúrico com nitrato de potássio pode ser usada para produzir ácido nítrico juntamente com um precipitado de bissulfato de potássio. Com o próprio ácido nítrico, o ácido sulfúrico age tanto como ácido quanto como um agente desidratante, com a formação do íon nitrônio (NO2+), muito importante em diversas reações em Química Orgânica, como por exemplo na esterificação de Fischer e na desidratação de álcoois.
O ácido sulfúrico reage com a maioria dos metais, em uma reação de deslocamento simples, com a formação de gás hidrogênio e o sulfato do metal correspondente. O ácido sulfúrico diluído ataca o ferro, o alumínio, o zinco, o manganês e o níquel; o estanho e o cobre já precisam de ácido quente concentrado. O chumbo e o tungstênio são inertes ao ácido sulfúrico. A reação com o ferro (mostrada abaixo) é uma reação típica para boa parte dos metais.
- Fe(s)+H2SO4→H2(g)+FeSO4{displaystyle Fe_{(s)}+H_{2}SO_{4}rightarrow H_{2(g)}+FeSO_{4};!}
A reação do ácido sulfúrico com o estanho é atípica, porque forma dióxido de enxofre no lugar do hidrogênio.
- Sn(s)+2 H2SO4(conc)→SnSO4+2 H2O+SO2{displaystyle Sn_{(s)}+2 H_{2}SO_{4(conc)}rightarrow SnSO_{4}+2 H_{2}O+SO_{2};!}
Apesar de ser um forte oxidante, o ácido sulfúrico(mesmo concentrado) não é capaz de oxidar o cloro, do cloreto de sódio, ocorre assim, a seguinte reação:
- NaCl(s)+H2SO4(conc)→NaHSO4(s)+HCl(g){displaystyle NaCl_{(s)}+H_{2}SO_{4(conc)}rightarrow NaHSO_{4(s)}+HCl_{(g)};!}
Entretanto, é capaz de oxidar o bromo e o iodo, como seguem as reações:
- 2 NaBr(s)+H2SO4(conc)→Na2SO3(s)+H2O(g)+Br2(g){displaystyle 2 NaBr_{(s)}+H_{2}SO_{4(conc)}rightarrow Na_{2}SO_{3(s)}+H_{2}O_{(g)}+Br_{2(g)};!}
- 2 NaI(s)+H2SO4(conc)→Na2SO3(s)+H2O(g)+I2(g){displaystyle 2 NaI_{(s)}+H_{2}SO_{4(conc)}rightarrow Na_{2}SO_{3(s)}+H_{2}O_{(g)}+I_{2(g)};!}
Produção industrial |
O ácido sulfúrico é produzido a partir de enxofre, oxigênio e água via processo de contato.
Na primeira etapa, o enxofre é queimado ao ar, produzindo dióxido de enxofre.
O dióxido de enxofre, por sua vez, é oxidado a trióxido de enxofre com o uso de oxigênio e na presença de um catalisador de pentóxido de vanádio:
- 2 SO2+O2(g)⟶ 2SO3(g){displaystyle 2 SO_{2}+O_{2(g)}longrightarrow 2SO_{3(g)}}
Finalmente, o trióxido de enxofre é lavado com água ou uma solução de ácido sulfúrico, com a formação de uma solução de ácido sulfúrico 98-99%:
- SO3(g)+H2O(l)→H2SO4(l){displaystyle SO_{3(g)}+H_{2}O_{(l)}rightarrow H_{2}SO_{4(l)};!}
Observe que a dissolução direta de SO3 em água é impraticável por causa da natureza altamente exotérmica da reação. Forma-se uma névoa ao invés de um líquido. Alternativamente, o SO3 é absorvido em H2SO4 para formar oleum (H2S2O7), que é então diluído, com a formação de ácido sulfúrico.
- H2SO4(l)+SO3→H2S2O7(l){displaystyle H_{2}SO_{4(l)}+SO_{3}rightarrow H_{2}S_{2}O_{7(l)};!}
O oleum reage com água para formar H2SO4 concentrado.
H2S2O7(l)+H2O(l)→2 H2SO4(l){displaystyle H_{2}S_{2}O_{7(l)}+H_{2}O_{(l)}rightarrow 2 H_{2}SO_{4(l)};!}[5]
Recentemente, a partir dos gases ácidos, como o sulfeto de hidrogênio, presente no gás natural, nos gases derivados de petróleo e de gás de síntese, desenvolveu-se o processo de ácido sulfúrico a úmido.
Usos |
O ácido sulfúrico é uma commodity muito importante. Na verdade, a produção de ácido sulfúrico de uma nação é um bom indicador da sua força industrial. O principal uso (60% do total mundial) do ácido sulfúrico é na produção de ácido fosfórico por via úmida que, por sua vez, é usado na produção de fertilizantes fosfatados e de trifosfato de sódio, usado em detergentes. A matéria-prima usada para a fabricação de ácido fosfórico na equação a seguir é a fluorapatita, embora a composição exata possa variar. O mineral é tratado com ácido sulfúrico a 93% com a formação de sulfato de cálcio, fluoreto de hidrogênio (HF) e ácido fosfórico. O HF é removido na forma de ácido fluorossilícico. O processo global pode ser representado como:
- Ca5(PO4)3F+5 H2SO4+10 H2O→5 CaSO4⋅2H2O+HF+3 H3PO4{displaystyle Ca_{5}(PO_{4})_{3}F+5 H_{2}SO_{4}+10 H_{2}Orightarrow 5 CaSO_{4}cdot 2H_{2}O+HF+3 H_{3}PO_{4};!}
Os fertilizantes sulfatados, com por exemplo sulfato de amônio, são feitos com o uso de ácido sulfúrico, embora em menores quantidades do que os fosfatados.
Outro uso importante do ácido sulfúrico é na fabricação de sulfato de alumínio. Este sal reage com pequenas quantias de sabão em fibras de polpa de papel de forma a dar carboxilatos gelatinosos de alumínio, que ajudam na coagulação das fibras para formar o papel propriamente dito. O sal de alumínio também é usado para fazer hidróxido de alumínio, que é usado em plantas de tratamento de água para filtrar impurezas e melhorar o sabor da água. O sulfato de alumínio é feito pela reação da bauxita com ácido sulfúrico:
- Al2O3+3 H2SO4→Al2(SO4)3+3 H2O{displaystyle Al_{2}O_{3}+3 H_{2}SO_{4}rightarrow Al_{2}(SO_{4})_{3}+3 H_{2}O;!}
O ácido sulfúrico é ainda usado para diversos outros fins na indústria química. Por exemplo, é o catalisador ácido comum na conversão de ciclohexanona oxima em caprolactama, que é usada para fazer Nylon; é usado com sal para a fabricação de ácido clorídrico; no refino de petróleo, é um catalisador da reação do isobutano com isobutileno, que dá iso-octano (2,2,4-trimetilpentano), um composto que aumenta a octanagem da gasolina; é usado para a fabricação de vários pigmentos.
As baterias de chumbo-ácido presente em automóveis são recarregáveis e também contêm ácido sulfúrico como eletrólito. A bateria deste tipo é composta de células com placas de chumbo-ácido. Cada célula produz 2 volts, e uma bateria com 6 células produz 12 volts. O ácido sulfúrico também é o principal ingrediente de alguns tipos de substâncias desentupidoras de pia especializadas em desbloquear entupimentos com papel, pedaços de tecido e outros materiais não facilmente dissolvidos por soluções cáusticas.
Referências
↑ abcde Registo de Schwefelsäure na Base de Dados de Substâncias GESTIS do IFA, accessado em 7 de Março de 2008
↑ ab Tabelle von Säurekonstanten von der ETH Zürich
↑ Sicherheitsdatenblatt (Carl Roth) 96 %ige Schwefelsäure
↑ [1]
↑ THE CONTACT PROCESS - www.chemguide.co.uk (em inglês)















