Éster
Na química orgânica e bioquímica, um éster é o produto formal da reação de um oxiácido (geralmente orgânico) com um álcool, fenol, heteroarenol ou enol, pela perda formal de água, formada pelo hidrogênio ácido do primeiro com o grupo hidroxila do segundo.[1]
No caso do ácido ser um ácido carboxílico, o hidrogênio do ácido R-COOH é substituído por um grupo alquilo ou arilo R". Neste caso, os ésteres constituem o grupo funcional (R'-COOR").
Os ésteres mais comuns que se encontram na natureza são as gorduras e os óleos vegetais, os quais são ésteres de glicerol e de ácidos graxos.
Os ésteres resultam frequentemente da condensação (uma reação que produz água) de um ácido carboxílico e de um álcool. Ao processo dá-se o nome de esterificação.
Índice
1 Ésteres de ácidos orgânicos
1.1 Nomenclatura
2 Métodos de preparação
2.1 Esterificação
2.2 Processo petroquímico
2.3 Outras reações
3 Propriedades
3.1 Físicas
3.2 Químicas
3.2.1 Hidrólise
3.2.2 Saponificação
4 Segurança
5 Eliminação
6 Ocorrência
7 Usos e aplicações
8 Ver também
9 Referências
Ésteres de ácidos orgânicos |
Os ésteres são derivados de álcoois pela substituição do hidrogênio do ácido por um radical orgânico. São possíveis ésteres sulfurados (exemplo: acetil-CoA), ésteres de fosfato (ex: ATP), porém os mais importantes são os ésteres de ácidos carboxílicos. Alguns deles estão representados abaixo:
Fórmula geral: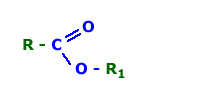 onde R e R1 são grupos alquilas
onde R e R1 são grupos alquilas- Exemplos:
Nomenclatura |
- (Nome do ânion derivado do ácido substituindo o sufixo ICO por ATO) de (Nome do grupo alquila)
- CH3COO - CH3→ Acetato de metila ou etanoato de metila
- CH3 - CH2 - COO - CH2 - CH3→ propanoato de etila
- CH3 - COO - CH2 - CH2 - CH2 - CH3→ Etanoato de butila
- CH2 = C (CH3) - COO - CH3→ metil propenoato de metila, o monômero do acrílico (plástico).
Métodos de preparação |
Esterificação |
Os ésteres também podem ser preparados a partir da reação ácido (geralmente orgânico) com um álcool (o hidrogênio do ácido R-COOH é substituído por um grupo alquilo R") ou um cloreto ou anidrido de ácido com álcool ou fenol.
Na prática, de uma maneira genérica, a velocidade das reações de esterificação é acelerada pela presença de íons H+, por isto, adiciona-se um pouco de HCl, por exemplo, que atuará como catalisador. Numa reação de esterificação nunca se obtém 100% de rendimento em éster e água, pois somente uma parte do álcool e do ácido reagem, obtendo-se um equilíbrio com as quatro espécies químicas: álcool, ácido carboxílico, éster e água.[2]
- CH3COOH + C2H5OH ⇌{displaystyle rightleftharpoons }
CH3COOC2H5 + H2O
Como uma prática laboratorial, para catalisar a síntese do éster é adicionado um catalisador ácido, por exemplo, o ácido sulfúrico, em um balão de vidro. A solução contendo o ácido sulfúrico e os componentes deve ficar sob aquecimento por uma hora. A fim de a mistura não evaporar, deve-se adaptar um condensador de Allihn (um condensador de refluxo) ao balão com mangueiras conectadas á água em seu interior para que ocorra o resfriamento do tubo. Após a reação lavar o produto com água, neutralizar o ácido sulfúrico com uma solução de bicarbonato de sódio saturada e então separar o éster, que separa da água e forma uma camada menos densa, que pode ser separada da camada aquosa inferior.
Processo petroquímico |
Obtenção de ésteres a partir da reação de ácidos com alcenos:
Exemplo: Ácido propanoico + propeno → propanoato de isopropila
- CH3-CH2-COOH + CH2=CH-CH3 → CH3-CH2-COO-CH(CH3)-CH3
Os ésteres também podem ser preparados a partir da reação de um cloreto ou anidrido de ácido com álcool ou fenol.
Outras reações |
Rearranjo de Favorskii de uma α-halocetona na presença de uma base;
Oxidação de Baeyer-Villiger de cetonas e peróxidos;
Reação de Pinner de um nitrilos com um álcool;
Abstração de um Nucleofílio de um composto de um acilo-metal ;- Hidrólise de um composto de ortoéster em um ácido aquoso;
Propriedades |
Físicas |
- Em geral, líquidos voláteis, incolores, de odor agradável àqueles que apresentam massas moleculares menores.
- Líquidos viscosos, xaroposos e gordurosos aqueles que apresentam massas moleculares médias.
- Sólidos com aspecto de cera aqueles que apresentam as maiores massas moleculares.
- Praticamente não apresentam polaridade molecular.
- Insolúveis em água, entretanto, solúveis em álcool.
- Como não apresentam pontes de hidrogênio possuem pontos de fusão e ebulição inferiores aos dos ácidos e álcoois de mesma massa molecular.
Químicas |
Hidrólise |
do Gr. hýdor, água + lýsis, dissolução:
É uma reação química, em que um dos reagentes é a água. Através desta reação grandes moléculas como os lipídios, por exemplo, são decompostos em moléculas menores que os constituem.
Há basicamente dois tipos de hidrólise de ésteres: ácida e básica.
A hidrólise ácida ocorre em meio ácido e é um processo reversível, gerando um álcool e um ácido carboxílico:
- R-COO-R1 + HOH ⇌{displaystyle rightleftharpoons }
R-COOH + HO-R1
A hidrólise básica, ou saponificação, é realizada em meio básico. Trata-se de um processo irreversível, gerando álcool e um sal de ácido carboxílico:
- R-COO-R1 + BOH(aq) → R-COO-B+ + HO-R1
Onde BOH é uma base, por exemplo, KOH.
Saponificação |
É a reação de um éster com uma base originando um sal orgânico e um álcool.
Exemplo: Etanoato de metila + NaOH → etanoato de sódio + álcool metílico
- CH3-COO-CH3 + NaOH → [CH3-COO][Na] + CH3-OH
Ou seja, a reação orgânica descrita ocorre quando misturamos algum tipo de Ester (gordura vegetal ou animal; óleos; essências de frutas, flores e madeira; nas ceras de carnaúba e abelha, etc....) com hidróxido de sódio (soda cáustica) ou potassa cáustica, que pode ser encontrada na cinza vegetal. O calor produzido ao misturar-se os óleos ou gorduras, um álcali e água pura é suficiente para iniciar-se a reação química. Essa reação pode originar um sal orgânico e um álcool.
A saponificação pode ser aplicada em:
- produção de flavorizantes para a produção de refrescos, doces, pastilhas, xaropes, balas e etc.
- produção de sabões;
- como medicamentos;
- produção de perfumes e cosméticos;
- na alimentação.
Resumindo: saponificar é converter um corpo graxo em sabão ou em outras substâncias.
Segurança |
Eliminação |
Os ésteres podem ser hidrolisados aos respectivos ácido e álcool, sendo o ácido transformado num sal e o álcool dissolvido em água suficiente.
Ocorrência |
Os ésteres são substâncias comuns na natureza. São encontrados:
- Nos óleos e nas gorduras.
- Nas essências de frutas, de madeiras e de flores.
- Nas ceras como a de carnaúba e a de abelhas.
- Nos fosfatídeos como os existentes no ovo e no cérebro.
Pela sua ocorrência na natureza, os ésteres podem ser classificados em três classes.
Os ésteres essenciais de flores e frutas, normalmente constituídas de cadeias de carbono pequenas e médias (até 8 carbonos). Possuem aroma agradável e estão presentes em flores e frutos. São obteníveis artificialmente e empregadas em alimentos como refrigerantes, sorvetes, doces, balas e em xaropes diversos. Um exemplo é o formiato de etila (HCOOC2H5), empregada como extrato artificial para xaropes de groselhas, rum, etc.[2]
Determinados ésteres são usados isoladamente, como o acetato de amila, com forte aroma de banana (chamado, inclusive, comercialmente, de essência de banana. O acetato de octilo é usado como essência artificial de laranja. Outros são usados compostos com outras substâncias, para formular essências diversas, como o acetato de etila, que participa de formulações de essências artificiais de maçã, pera, framboesa, pêssego, groselha, etc.[2]
Os lipídios e gorduras.
As ceras orgânicas ou cerídeos.
Usos e aplicações |
- Produção de flavorizantes para a produção de refrescos, doces, pastilhas, xaropes, balas, etc.
- Produção de sabões.
- Produção de alguns medicamentos.
- Produção de perfumes e cosméticos.
- Na alimentação.
- Na produção de biocombustíveis.
Ver também |
- Óleo
- Gordura
- Flavorizante
- Sabão
- Margarina
Referências
↑ IUPAC, Compêndio de Terminologia Química, 2ª ed. ("Gold Book"). Compilado por A. D. McNaught e A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Versão online: "ester" (2006–) criado por M. Nic, J. Jirat, B. Kosata; atualizações compiladas por A. Jenkins. ISBN 0-9678550-9-8.
↑ abc SAFFIOTI, WALDEMAR; Fundamentos de Química; Companhia Editora Nacional; São Paulo, Brasil; 1968.
 onde R e R1 são grupos alquilas
onde R e R1 são grupos alquilas